El fondo de inversión estadounidense Voleon Capital Management ha subido su posición corta en Oryzon Genomics hasta el 2,660% de su capital, alcanzando así su nivel más alto desde que hay registros, según la información remitida a la Comisión Nacional del Mercado de Valores (CNMV).
Este movimiento se enmarca en la captación de 30 millones de euros por parte de la firma biotecnológica en una ampliación de capital internacional, mediante la emisión de 12.765.958 nuevas acciones, con el objetivo de facilitar su potencial acceso al Nasdaq.
Oryzon Genomics prevé emplear los ingresos netos obtenidos en esta operación para fortalecer y optimizar sus actividades generales, administrativas y financieras, así como para avanzar en la preparación de la posible admisión a negociación ('dual listing') de sus acciones en el mercado estadounidense.
El contexto también está marcado por el interés demostrado por distintas farmacéuticas estadounidenses hacia la compañía española, cuya primera molécula, vafidemstat, obtuvo a principios de 2025 resultados satisfactorios.
Fuentes de Oryzon Genomics consultadas por Europa Press ya confirmaron la existencia de "conversaciones confidenciales con varias farmacéuticas interesadas", una cuestión que la compañía había señalado en otras ocasiones, al tiempo que valoraron positivamente el "creciente" interés de las empresas en el ámbito de la salud mental.
El 'modus operandi' de un inversor bajista que opera con cortos implica que tiene que tomar prestadas acciones de un tercero para venderlas en los mercados y luego recomprarlas y devolvérselas a su dueño original. El beneficio así se obtiene cuando la cotización de un valor cae.
Voleon afloró su primera posición corta en Oryzon Genomics el pasado 21 de marzo, con un 0,55% del capital, porcentaje que representa el mínimo histórico, mientras que el máximo comunicado por la gestora se elevó al 2,66% el 14 de octubre.
La apuesta del fondo sobre la farmacéutica ha aumentado un 383,64% entre el 21 de marzo, fecha del primer registro comunicado, y el 14 de octubre, último dato disponible.
SUBE UN 134% EN BOLSA EN LO QUE VA DE AÑO
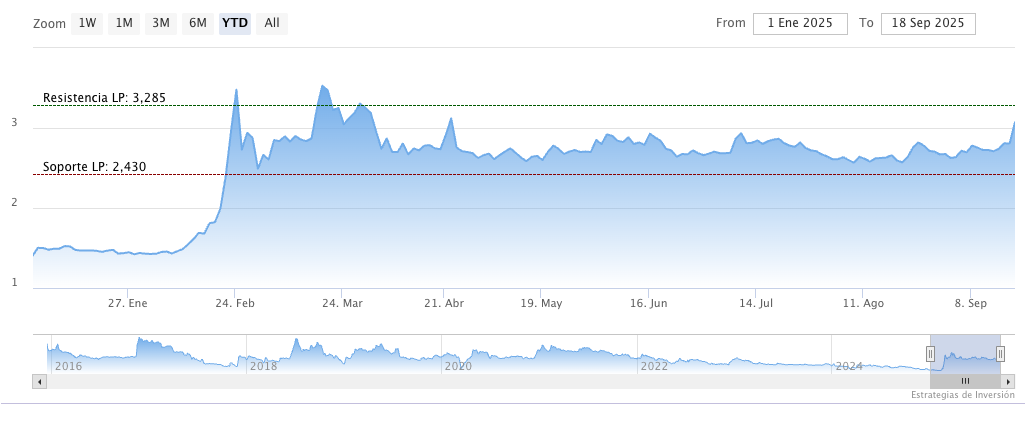
Este jueves, las acciones de Oryzon Genomics subían un 1,4% en el Mercado Continuo, donde cotiza, situándose en 3,515 euros por título hacia las 10.05 horas.
En lo que va de año, la compañía española acumula una revalorización del 134%, tras marcar un máximo anual de 3,8 euros el pasado 25anr de septiembre y un mínimo de 1,422 euros el 28 de enero.
"El valor de la acción tiene un importante recorrido con respecto al consenso de precio objetivo dado por los distintos analistas", han explicado en fuentes de la compañía a Europa Press.
Según los registros de Bloomberg, los seis analistas que siguen Oryzon Genomics recomiendan 'comprar' sus acciones. Roth Capital Partners sitúa el precio objetivo más alto, en 12 euros por título, mientras que Jefferies fija el más bajo, en 4 euros.
Entre los hitos a tener en cuenta en el impulso de la cotización, la empresa se ha referido al "reciente impulso del programa de 'iadademstat' con la aprobación de la Agencia Europea de Medicamentos (EMA) para iniciar un estudio abierto de 'Fase 2' para establecer la RP2D en anemia falciforme